【抗疫之路】新招合成mRNA 疫苗效用更持久

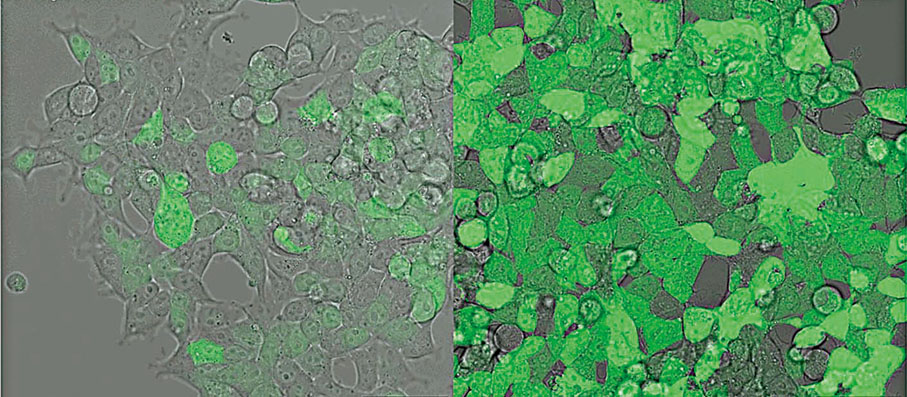
科大揭改尾鏈序列升蛋白質產量10倍 可減劑量或注射頻率
合成信使核糖核酸(mRNA)技術近年被廣泛應用在包括新冠疫苗等不同疫苗和藥物中,注射這些疫苗後,人體便產生不同蛋白質對抗病毒,但往往需要重複注射多次或使用較高劑量的mRNA,或會為身體帶來副作用。香港科技大學團隊發現,透過優化mRNA序列鏈中的尾鏈序列,可提升蛋白質生產量高達10倍,以及延長其生產蛋白質的持續時間達一倍。研究有望使mRNA藥物或疫苗效用更為顯著及持久,並減少使用劑量或注射頻率,從而減低治療成本及副作用。有關發現最近已於科學期刊《分子療法—核酸》的線上版發表。◆香港文匯報記者 金文博
科大化學及生物工程學系助理教授曠怡昨日在記者會上介紹指,由人工合成的mRNA藥物和疫苗,在基因治療、再生醫學、癌症治療和傳染病預防都被大量應用,它進入人體後會製造不同的抗原蛋白質,誘發人體免疫系統產生抗體以對抗病毒。由於只有mRNA的尾鏈才能製造蛋白質,但當其進入細胞後會逐漸被酶分解消失,因此為了令身體產生足夠的蛋白質,現時的mRNA藥物和疫苗大都需要重複多次注射,或使用較高的劑量,治療成本相對高,同時或會為人體帶來較多的副作用。
胞嘧啶C助減緩mRNA分解
對此,曠怡和團隊經過3年對mRNA各種序列組合的反覆測試後,發現若於尾鏈序列中,在特定位置以胞嘧啶C核鹼基取代腺嘌呤A核鹼基,使原來全由腺嘌呤A組成的尾鏈序列,變成有20%是胞嘧啶C,即可減緩mRNA的分解,從而增加蛋白質產量和持續生產時間。
曠怡指出,不同的mRNA藥物都受益於尾鏈序列的優化,例如在實驗用的模擬疫苗中,優化後的尾鏈序列比優化前能在人類細胞產生逾6倍的抗原蛋白,而在模擬藥物中更能產生超過10倍的蛋白質。
此外,研究人員亦在小鼠體內觀察到逾3倍的蛋白質產量增加,蛋白質在小鼠體內存在的時間亦延長1倍,由原本優化前的24小時,增加至48小時,並到72小時後才完全消失。
曠怡強調,模擬藥物始終不比真正研發出來的藥物,而人類細胞亦與真正的人體相差甚遠,但從小鼠的實驗觀察來看,希望藥效至少可以「翻三倍」。
冀引進到mRNA療法疫苗開發
她表示,優化尾鏈序列後的合成mRNA藥物及疫苗有多項優點,包括在將其用量減半的同時仍可產生更多蛋白質,使療效更顯著和持久,更可與現有編輯其他mRNA序列鏈部分的技術並用,減少劑量和注射次數亦可減低病人接受治療時的痛苦,現已為研究申請專利,團隊亦正與中山大學合作,探索進一步將優化的mRNA尾鏈用在動物上進行癌症疫苗測試,期待日後與藥廠合作,將其引進到mRNA療法和疫苗的開發上,以造福社會。
